GMP洁净区(室)环境监测仪器
GMP验证环境监测仪器:尘埃粒子计数器(RBD-900)、浮游菌采样器(RE-300)、风速仪(RE-312)、数字微风速仪(RE-1215)、风量罩(TSLD-1601)、压差计(RE-9000)、温湿度仪(SK-200)、温湿度计、噪音计(RE-1360)、照度计(RE-1329)、高效过滤器检漏仪等(TATE-1-3) 、气流可视化测试仪(GLK-1201)。上海雷若仪表 主营认证仪器
环境参数的设计标准: 制药GMP认证风速计/数字微风速仪
1、药品生产洁净室(区)空气洁净度分为四个等级
表4 洁净室(区)空气洁净度级别表
洁净级别 | 尘粒zui大允许数/m3 | 微生物数量zui大允许数 | ||
≥0.5μm | ≥5μm | 浮游菌/m3 | 沉降菌/皿 | |
100级 | 3 500 | 0 | 5 | 1 |
10 000级 | 350 000 | 2 000 | 100 | 3 |
100 000级 | 3 500 000 | 20 000 | 500 | 10 |
300 000级 | 10 500 000 | 60 000 | — | 15 |
药品生产环境对洁净度的具体分区要求如下:
100级洁净区:zui终灭菌药品如大输液的灌封工序;非zui终灭菌药品的药液的配制(灌装前不需除菌滤过的),注射剂灌封、分装、压塞,内包装材料zui终处理后的暴露环境;质量标准中列有无菌检查项目的原料药的生产;灌装前不经除菌滤过的生物制品的配制、合并、灌装、冻干、加塞、添加稳定剂、佐料和灭活剂等工序。
上海雷若仪表专业提供GMP认证仪器
10,000级洁净区:zui终灭菌的药品如小容量注射剂的灌封,注射剂的稀配、滤过,内包装材料的zui终处理(精洗)等;非zui终灭菌药品的药液配制(灌封前需除菌滤过的);供角膜创伤、手术用滴眼剂的配制、灌封;灌装前经除菌滤过的生物制品的配制、合并、精制,添加稳定剂、佐料、灭活剂,除菌过滤、超滤、灌封等;体外免疫诊断试剂阳性血清分装、抗原-抗体分装等。
1000,000级洁净区:zui终灭菌药品的药液浓配、稀配;非zui终灭菌药品轧盖,内包装材料zui后一次精洗的zui低要求;非zui终灭菌口服液、深部组织创伤外用药品、眼用药品、腔道用药(除直肠用药外)生产的暴露工序;原料血浆的合并、非低温提取、分装前的巴氏消毒、轧盖以及制品的zui终容器的清洗;口服制剂生产的暴露工序;发酵培养密闭系统的环境(暴露工序需无菌操作);霉联免疫吸附试剂配液、分装、干燥、包装;体外免疫试剂生产的暴露工序;深部组织创伤、大面积体表创面用生物制品的配制、灌装。上海雷若仪表专业提供GMP认证仪器
300,000级洁净区:口服固体制剂,zui终灭菌的口服液体制剂,表皮外用药品,直肠用药,放射免疫分析药盒等生产的暴露工序;原料药生产暴露工序的zui低要求。
2、温度和相对湿度(SK-200) 制药GMP认证风速计/数字微风速仪
洁净室(区)的温度和相对湿度应与药品生产工艺相适应。无特殊要求时,温度应控制在18~26℃,相对温度应控制在45%~65%。
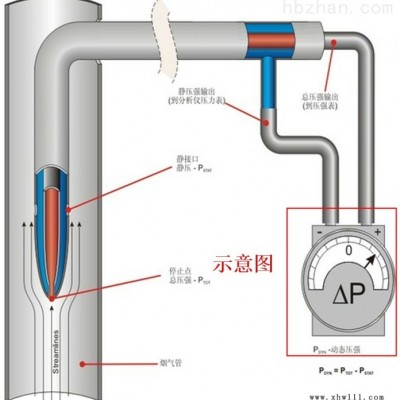
3、压差计(RE-9000) 制药GMP认证风速计/数字微风速仪
(1)洁净室必须维持一定的正压,可通过使送风量大于排风量的办法达到,并应有指示压差的装置。
(2)空气洁净度等级不同的相邻房间之间的静压差应≥5Pa,洁净室(区)与室外大气的静压差应
≥10Pa,并应有指示压差的装置。
(3)工艺过程产生大量粉尘、有害物质、易燃易爆物质及生产青霉素类强致敏药物,某些甾体药
物,任何认为有致病作用的微生物的生产工序,其操作室与其相邻房间或区域应保持相对负压。
4、新鲜空气量(风量罩TSLD-1601)
洁净室内应保持一定的新鲜空气量,其数值应取下列风量中的zui大值:
(1) 非单向流洁净室应为总送风量的10%~30%,单向流洁净室应为总送风量的2%~4%;
(2)补偿室内排风和保持正压值所需的新鲜空气量;
(3)保证室内每人每小时的新鲜空气量不小于40m3。
5、照度计(RE-1329)
洁净室(区)应根据生产要求提供足够的照明。主要工作室的照度宜为300Lux;在辅助工作室、走廊、气闸室、人员净化和物料净化用室可低于300Lux,但不宜低于150Lux;对照度不特殊要求的生产部位可设置局部照明,厂房应有应急照明设施。
6、噪声计(RE-1360)
洁净室内噪声级就符合下列要求:①动态测试时,洁净室的噪声级不宜大于75dBA;②静态测试时,乱流洁净室的噪声级不宜大于60dBA;层流洁净室的噪声级不宜大于65dBA。洁净厂房的噪声控制设计必须考虑生产环境的空气洁净度要求,不得因控制噪声而影响洁净室的净化条件。